试题详情
- 简答题如何用电化学的方法,测定H2O(l)的标准摩尔生成Gibbs自由能
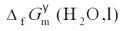 ?
?
- H.sub>2O(l)的生成反应为
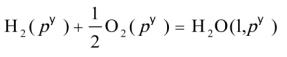
要设计一个电池,使电池反应与之相同。方程式中,显然H2(g)是被氧化的,将氢电极放在电池的左边作阳极,O2(g)是被还原的,将氧电极放在电池右边作阴极,这是一个氢-氧燃料电池。由于氢-氧燃料电池的电动势与电解质溶液的pH没有关系,所以两个电极中间的介质在pH等于之间都可以,只要保持H2(g)和O2(g)的压力都是标准压力即可。所以设计的电池为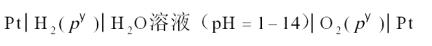
这个电池的反应就是H2O(l)的生成反应,测定电池的标准可逆电动势(或从标准电极电势表,查阅电极的标准电极电势,进行计算得到),就可以计算H2O(l)的标准摩尔生成Gibbs自由能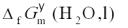
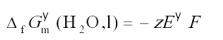 。
。 关注下方微信公众号,在线模考后查看

热门试题
- 将1molSO2与
- 1mol理想气体绝热向真空膨胀,体积从V
- 某溶胶粒子的平均直径为4.2nm,介质粘
- NaCl水溶液和定压纯水经半透膜达成渗透
- 在“标准电极电势表”中列出的电极电势E°
- 指出下列平衡系统中的组分数C,相数P及自
- 表面现象在自然界普遍存在,但有些自然现象
- 298K时和标准压力下,以Pt(s)为阳
- 理想气体向真空膨胀,当一部分气体进入真空
- 理想气体恒压热容与恒容热容之差为()
- 固体碘化银(AgI)有α和β两种晶型,这
- 理想气体反应2A(g)→Y(g
- 反应2A+B→3P的反应速率等
- 将同样量的两小水滴中之一灌在玻璃毛细管中
- 已知A液体的沸点比B液体高,且两者能形成
- 糖可以顺利地溶解在水中,这说明固体糖的化
- 半透膜两边离子的起始浓度(单位为mol&
- 常用的洗涤剂中为什么含有磷?有什么害处?
- NH4HS(s)和
- 统计热力学中的热力学概率()