试题详情
- 简答题CO2(g)与H2S(g)在高温的反应为:
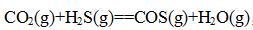 今在610K时将4.4g的CO2(g)加入体积为2.5dm3的空瓶中,然后再充入H2S(g)使总压为1000kPa.。达平衡后取样分析,得其中含H2O(g)的摩尔分数为0.02。将温度升至620K重复上述实验,达平衡后取样分析,得其中含H2O(g)的摩尔分数为0.03。视气体为理想气体,度计算: (1)610K时的
今在610K时将4.4g的CO2(g)加入体积为2.5dm3的空瓶中,然后再充入H2S(g)使总压为1000kPa.。达平衡后取样分析,得其中含H2O(g)的摩尔分数为0.02。将温度升至620K重复上述实验,达平衡后取样分析,得其中含H2O(g)的摩尔分数为0.03。视气体为理想气体,度计算: (1)610K时的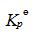 ; (2)610K时的
; (2)610K时的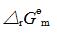 ; (3)反应的标准摩尔焓变
; (3)反应的标准摩尔焓变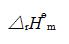 (设其不随温度而变); (4)在610K时,往该体积的瓶中充入不参与反应的气体,直至压力加倍,则COS(g)的产量有何变化,若充入不参与反应的气体,保持压力不变,而使体积加倍,则COS(g)的产量又有何变化?
(设其不随温度而变); (4)在610K时,往该体积的瓶中充入不参与反应的气体,直至压力加倍,则COS(g)的产量有何变化,若充入不参与反应的气体,保持压力不变,而使体积加倍,则COS(g)的产量又有何变化?

关注下方微信公众号,在线模考后查看

热门试题
- KOH,HCl,KCl三种浓度相同的稀溶
- 对恒沸混合物的描述,下列各种叙述中哪一种
- 1mol甲苯在其沸点383.2K时蒸发为
- 1molH2与过量
- 在一绝热钢壁体系内,发生一化学反应,温度
- 在373K下,S0m(H2
- 在一封闭的容器中,一物质处于气液两相平衡
- 在101.3kPa下,110℃的水变为1
- 化学势不适用于整个化学反应体系,因此,化
- 半透膜内放置羧甲基纤维素钠溶液,其浓度为
- 三组分体系中,可能平衡共存的相数最多有(
- 293K下HCl溶于苯中达平衡,气相中H
- 用COS5020G示波器的CH
- 下述说法哪一个是错误的?()
- 影响Kθ1(理想气
- 在玻璃杯里倒上半杯开水,会发现玻璃杯的上
- 一定量的气体,从始态A变化到终态B,系统
- 单分子反应一定是基元反应。
- 在标准压力下,90℃的液态水气化为90℃
- 体系从状态I变化到状态Ⅱ,若ΔT=0,则