试题详情
- 简答题已知下列半反应:
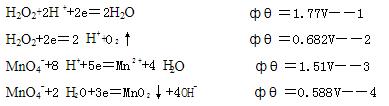 问: 以KMnO4法测定过氧化氢时,是基于上述那两个半反应?反应的基本原理是什么? 从上述半反应可以看出,在KMnO4法测定H2O2的反应条件是什么?为什么? 写出KMnO4法测定过氧化氢的反应式 以0.1mol/l的KMnO4滴定含量大约在15%左右的双氧水,为保证滴定数据的准确性,应称量多少克?
问: 以KMnO4法测定过氧化氢时,是基于上述那两个半反应?反应的基本原理是什么? 从上述半反应可以看出,在KMnO4法测定H2O2的反应条件是什么?为什么? 写出KMnO4法测定过氧化氢的反应式 以0.1mol/l的KMnO4滴定含量大约在15%左右的双氧水,为保证滴定数据的准确性,应称量多少克?
- (1)测定过氧化氢时是基于 H2O2+2e=2 H ++O2↑ 和MnO4-+8 H ++5e=Mn2++4 H2O 两个半反应。反应原理:在酸性介质中,过氧化氢与高锰酸钾发生氧化还原反应,根据高锰酸钾标准滴定溶液的消耗量,计算双氧水含量。
(2)应在强酸性条件下进行测定,因为高锰酸钾在中性、碱性和微酸性介质中会生成褐色的二氧化锰沉淀,影响终点判断。
(3)2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+8H2O+5O2↑
(4)C×V×M/W =15% 当V=25ml,解得W=0.28 g 。当V=35ml,解得W=0.40 g。所以应称量范围是0.28—0.40 g 关注下方微信公众号,在线模考后查看

热门试题
- 下列物质中可作汽车水箱防冻剂的物质是()
- 测定氯中含水前无需用干燥的空气转换吸收管
- 在光电比色中,滤光片透过的光应该是溶液最
- 气相色谱检测器按响应特性可分为()、()
- 非水滴定中,碱类化合物测定一般选用()为
- 在气相色谱法中,分离度R为()时,表明相
- 使用分析天平进行称量时,加减砝码或取放物
- 阳离子交换树脂含有可被交换的()活性基因
- 测定煤的灰分试验过程中,检查性灼烧时间规
- 25℃时10g水最多可溶解2g甲物质,5
- 元素铌在钢中的作用?
- 常用毛细管柱的口径范围在()。大口径(0
- (1)HCl+NaOH=H2<
- 天平的分度值越大,灵敏度越高。
- 在称样时,首先应检查天平是否水平。
- 某溶液主要含有Ca2+
- 一般来说,填充柱色谱仪载气流速设置在()
- 气相色谱仪中用TCD为检测器时,当桥电流
- 聚乙醇—20M的短时间最高使用温度为()
- 液谱色谱柱使用的注意事项是什么()。