试题详情
- 简答题 以0.02000mol/L EDTA滴定浓度均为0.02000mol/LPb2+、Ca2+混合液中的Pb2+,溶液pH为5.0。计算: (1)化学计量点时的lgK’(PbY)和[Pb2+]、[CaY]值。 (2)若以二甲酚橙为指示剂,此时[CaY]是多大? 已知pH=5.0时lgαY(H)=6.6、pPb终=7.0(二甲酚橙);lgK(PbY)=18.0,lgK(CaY)=10.7。
-
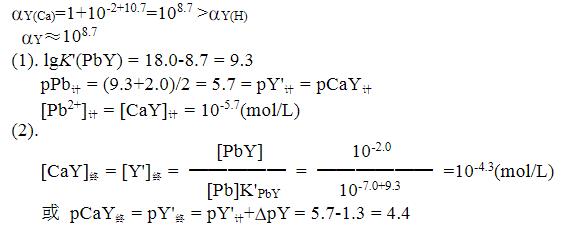
关注下方微信公众号,在线模考后查看

热门试题
- 某反25℃时K°=32,37℃时K°=5
- 100g水溶解20g非电解质的溶液,经实
- 配位反应中为什么要用缓冲溶液调节ph?
- 对Cu-Zn原电池的下列叙述不正确的是(
- 硅单质虽可有类似于金刚石结构,但其熔点硬
- 如果环上有两个不同的取代基不需要给取代基
- 用0.9810g纯锌和足量的盐酸反应,在
- HPO4
- 根据原子轨道的能级,人们将能量相近的轨道
- 蒸馏的目的是除去一部分溶剂使溶液增浓,进
- 在吸光光度法中,宜选用的吸光度读数范围为
- 中性(pH=7)的水是()
- 无定型沉淀的主要沉淀条件是()
- 298K时,在Fe3+
- 简述碘量法误差的主要来源。
- 今欲分别测定Ca2+
- 某难挥发非电解质0.6g溶于100mL水
- 络合滴定中,溶液的最低酸度是由金属离子的
- 求下列反应在298.15K时的平衡常数
- 简述原子吸收分光光度法的原理、优点,局限