试题详情
- 简答题 将0.120mol·L-1的AgNO3溶液与0.180mol·L-1Na2HPO4溶液等体积混合。 ①写出相应的离子反应方程式,并计算其标准平衡常数; ②计算有关离子的平衡浓度及溶液的pH (己知KspΘ(Ag3PO4)=8.7×10-17,Ka2Θ(H3PO4)=6.2×10-8,Ka3Θ(H3PO4)=4.5×10-13)。
-
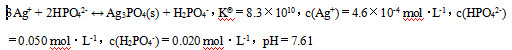
关注下方微信公众号,在线模考后查看

热门试题
- 配合物[Co(ONO)(NH3
- 试说明下列现象的原因。制备纯硼或硅时,用
- 芒硝和元明粉的化学式分别为()。
- 简述自蔓延高温合成的意义和类型。
- 写出氯气与钛、铝、氢、水和碳酸钾作用的反
- 简述第五、第六周期d区金属与第四周期d区
- 正反应能自发进行和反应达平衡的条件分别为
- 计算当溶液的pH分别等于4,8,12时,
- 煤中含有硫,燃烧时会产生有害的SO
- H2O2
- CH4和NH
- 某钠盐A溶于水后加入BaCl2
- 在晶格内仍能表示晶格特征的最基本*部分称
- 镧系收缩的结果之一是使Y成为稀土元素的成
- 抗癌药物[Pt(NH3
- PO43
- 下列分子或离子中,键角最小的是()。
- 完成并配平反应方程式:PbS+H
- 温度升高反应速率增加的主要原因是:反应分
- 在H3PO