试题详情
- 简答题 有气体反应A(g)=B(g)+C(g),由于逆反应速率系数k-1远小于正反应速率系数k1,故可看作是单向反应,并服从阿伦尼乌斯公式。已知其
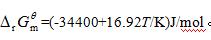 问: (1)增加温度对增大此反应的产量是否有利?对增大此反应的速率是否有利?简单解释判断的理由。 (2)设原始反应系统中只有气体A,其压力为101.325kPa,欲使上述反应在平衡时A的转化率达96%以上,并希望反应能在半小时内达到平衡,试根据化学热力学和化学动力学原理确定适宜的反应温度范围。 已知:正反应是一级反应,在700K其速率系数k1=10-4s-1(以A的浓度减低速率计);正反应活化能Ea=240kJ/mol。
问: (1)增加温度对增大此反应的产量是否有利?对增大此反应的速率是否有利?简单解释判断的理由。 (2)设原始反应系统中只有气体A,其压力为101.325kPa,欲使上述反应在平衡时A的转化率达96%以上,并希望反应能在半小时内达到平衡,试根据化学热力学和化学动力学原理确定适宜的反应温度范围。 已知:正反应是一级反应,在700K其速率系数k1=10-4s-1(以A的浓度减低速率计);正反应活化能Ea=240kJ/mol。
-

关注下方微信公众号,在线模考后查看

热门试题
- 在一抽空的刚性容器中,引入一定量纯气体A
- 某化学反应,已知反应物的转化分数为y=5
- 凡是在孤立体系中进行的变化,其&Delt
- 在90℃、p0下,
- 宏观测定的某种物理量实际上是相应微观量的
- 按照光化当量定律,在整个光化学反应过程中
- 对于反应物和生成物都是理想气体的化学反应
- 25℃时,测得电池 H<
- 液体A与B混合形成非理想混合物,当A与B
- 熟石灰在农业上有哪些用途?
- 对于多组分系统()。
- 在护工生产中,固体原料的焙烧,目前很多采
- 在确定的反应条件下,一个化学反应只有一个
- 下列反应AgCl(s)+I-<
- 胶束的出现标志着表面活性剂的()。
- 在一个细管中,于0.3327mol·dm
- 恒容下某复杂反应(取单位体积)的反应机理
- 某反应只有一种反应物,其转化率达到75%
- 下列各体系中属于独立粒子体系的是:()
- 下列对体系与环境的表述中正确的有()