试题详情
- 简答题具有2.00×10-3mol/L碱度的水,pH为7.0,计算[HCO3]、[HCO3-]、[CO3-2]和[HO-]的浓度?
-
该条件下,[HCO3-]=碱度=2.00×10-3mol/L
在pH=7.00时,[H+]=[HO-]=1.00×10-7mol/L
根据;K1=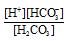 =4.45×10-7、[H+]和[HCO3-]浓度,求出[H2CO3]=4.49×10-4mol/L
=4.45×10-7、[H+]和[HCO3-]浓度,求出[H2CO3]=4.49×10-4mol/L
据K2= =4.68×10-11、[H+]、[HCO3-]浓度,求出[CO32-]=9.38×10-7mol/L
=4.68×10-11、[H+]、[HCO3-]浓度,求出[CO32-]=9.38×10-7mol/L
关注下方微信公众号,在线模考后查看

热门试题
- 土壤中硫的主要形态是()
- 简述为什么高层大气中有高浓度的原子氧和原
- 工业体系的生物物理基础是工业体系的一个决
- 下列土壤中物质对土壤的缓冲性能没有贡献的
- NOX在大气中的含
- 土壤中农药的扩散可以()和()两种形式进
- 伦敦烟雾又称作()
- 农药在土壤中的降解主要有()、()、()
- 影响有机物生物降解的因素有:()、()、
- 重金属在土壤-植物体系中的迁移过程与()
- 甲烷发酵需要满足()、()、()和()等
- 云下清除过程包括()及()的云下清除。
- 破碎腐蚀性废物时,破碎机的选型应考虑哪些
- 简述物质在生物体内的转运过程。
- 人为污染源主要来自()、()、()、()
- 丙酮酸在有氧条件下,通过(),转化为乙酰
- 试述水体富营养化产生的机理。
- 盐基饱和土壤中,土壤吸附的阳离子全是()
- 螯合物
- 间接节能,即节能的组织和管理措施包括结构