试题详情
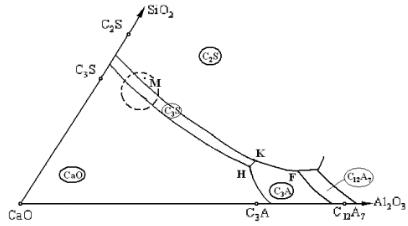
- 简答题 下图为CaO-A12O3-SiO2系统的富钙部分相图,对于硅酸盐水泥的生产有一定的参考价值。试: 1、画出有意义的付三角形; 2、用单、双箭头表示界线的性质; 3、说明F、H、K三个化合物的性质和写出各点的相平衡式; 4、分析M#熔体的冷却平衡结晶过程并写出相变式; 5、并说明硅酸盐水泥熟料落在小圆圈内的理由; 6、为何在缓慢冷却到无变量点K(1455℃)时再要急剧冷却到室温?
-
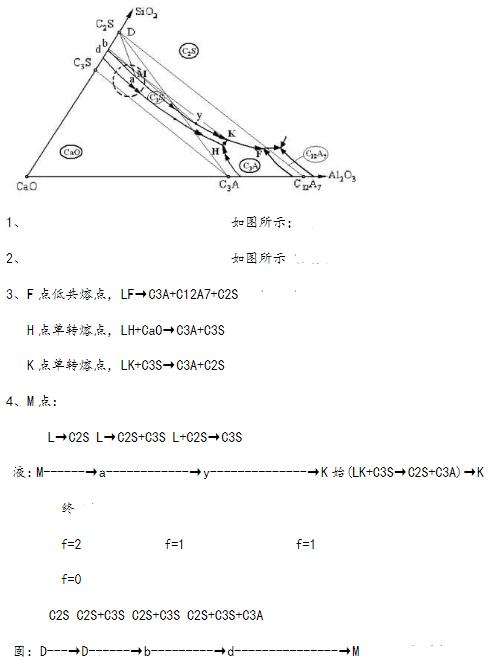
5.因为硅酸盐水泥熟料中三个主要矿物是C3S、C2S、C3A。根据三角形规则,只有当组成点落在C3S-C2S-C3A付三角形中,烧成以后才能得到这三种矿物。从早期强度和后期强度、水化速度、矿物的形成条件等因素考虑,水泥熟料C3S的含量应当最高,C2S次之,C3A最少。根据杠杆规则,水泥熟料的组成点应当位于C3S-C2S-C3A付三角形中小圆圈内。
6.因为缓慢冷却到K点,可以通过转熔反应L+C2S→C3S得到尽可能多的C3S。到达K点后,急剧冷却到室温,可以(1)防止C3S含量降低,因为K点的转熔反应LK+C3S→C2S+C3A;(2)使C2S生成水硬性的β-C2S,而不是非水硬性的γ-C2S;(3)液相成为玻璃相,可以提高熟料的易磨性。 关注下方微信公众号,在线模考后查看

热门试题
- 无规则网络假说
- 浓度差会引起扩散,扩散是否总是从高浓度处
- 简述热分析特点及在无机材料领域中的主要应
- 下列过程中,哪一个能使烧结体的强度增加而
- 简要比较衍射仪法与德拜照相法的特点。
- C2S有哪几种晶型
- 有一立方多晶样品拍摄的衍射花样中,各环的
- 假定碳在α-Fe(体心立方)和;γ-Fe
- 试分析二次再结晶过程对材料性能有何种效应
- UO2+x在氧化气
- 高铝水泥的配料通常选择在CA相区范围内,
- 试比较伊利石和蒙脱石的结构特点。
- 分析发生固态相变时组分及过冷度变化相变驱
- a=b≠c,α=β= 900,γ=120
- 请分析温度对相变热力学及动力学的影响。
- 已知氢和镍在面心立方铁中的扩散数据为cm
- 简述TG曲线及主要影响因素。
- 网络变性体(如Na2
- 如在液相中形成边长为a的立方体晶核时,求
- A,B进行反应生成AmBn,为扩散控制的