试题详情
- 简答题将下列反应组成原电池(温度298.15K):2I-(a)+2Fe3+(aq)= I2(s)+2Fe2+(aq)已知φ0(I2/I-)=0.5355V,φ0(Fe3+/Fe2+)=0.771V; (1)计算原电池的标准电动势; (2)计算反应的标准摩尔吉布斯函数变; (3)计算c(I-)=1.×10-2mol.dm-3以及c(Fe3+)= c(Fe2+)/10时电池的电动势。
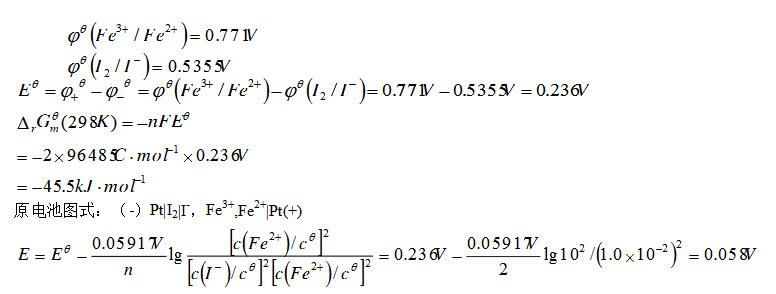
关注下方微信公众号,在线模考后查看

热门试题
- 根据离子极化理论解释:AgF、AgCl、
- Mg(OH)2(s
- 铜原子有29个电子,其电子分布式为()。
- 反应H2(g)+I
- 将下列水溶液按其凝固点的高低顺序排列。
- 敞开系统是指系统与环境之间()。
- 已知氨水溶液浓度为0.20mol·dm<
- 莫尔氏盐是一种稳定的盐,它的化学式是:(
- 若某反应的反应速率常数的单位为dm
- 主量子数=3,角量子数=1的原子轨道符号
- 氮元素与氧元素比较,第一电离能大的是()
- 钙原子的3P轨道能量高于3S轨道。
- 已知:[Zn(CN)4
- 反应速率只取决于温度,而与反应物或生成物
- 刚刚宰杀的肉味道鲜美、营养价值最高,这种
- 按照酸碱质子理论,下列哪一种物质既可作为
- 在298K,101Kpa时,反应&en
- 0.1 mol·
- 下列说法不正确*的是()
- 在5000C时,在1升密闭容器中,以1m