试题详情
- 简答题移取乙二醇试液25.00mL,加入0.02610mol·L-1KMnO4的碱性溶液30.00mL(反应式:HO-CH2CH2-OH+10MnO4-+14OH-=10MnO42-+2CO32-+10H2O);反应完全后,酸化溶液,加入0.05421mol·L-1Na2C2O4溶液10.00mL.此时所有的高价锰均还原至Mn2+,以0.02610mol·L-1KMnO4溶液滴定过量Na2C2O4,消耗2.30mL。计算试液中乙二醇的浓度。
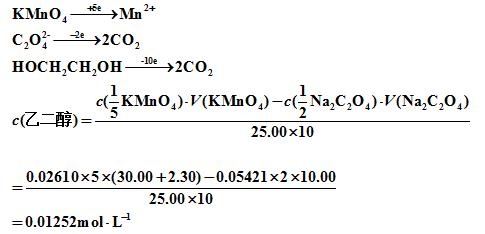
关注下方微信公众号,在线模考后查看

热门试题
- 溶剂的极性对有机化合物的紫外-可见吸收光
- 对有毒的废渣应及时处理,一般固体,可集中
- 若配制EDTA溶液的水中含Ca
- 所谓“真空紫外区”,其波长范围是()
- L=2的镁原子的光谱项数目为4,其中多重
- 配制好的KMnO4
- 为测定下列吡啶与水之间的质子转移反应的平
- 原子发射光谱的产生是由于()
- 若甲基橙的浓度为2.0×10-
- 滴定至临近终点时加入半滴的操作是怎样进行
- (1)计算pH=5.0时,H3
- 已知在c(H2SO
- 紫外可见光谱分析中的K吸收带是由()产生
- 分析条件是:强碱性、<200C。容器材料
- 用0.1000mol2
- 称取苯巴比妥钠(C12
- 原子吸收线和原子发射线
- 7890A中下面()原件不是控制隔垫吹扫
- 在ICP法中,什么叫观察高度?为什么观察
- 关于酸碱指示剂,下列说法不正确的是()