试题详情
- 简答题 对于一个在标准态下是吸热、熵减的化学反应,当温度升高时,根据吕·查德里原理判断,反应将向吸热的正方向移动;而根据公式
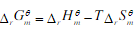 判断
判断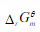 ,将变得更正(正值更大),即反应更不利于向正方向进行。在这两种矛盾的判断中,哪一种是正确的?简要说明原因。
,将变得更正(正值更大),即反应更不利于向正方向进行。在这两种矛盾的判断中,哪一种是正确的?简要说明原因。
-
前一种判断是正确的。当温度改变时,应用
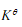 来判断平衡移动的方向。由范特霍夫等压方程式
来判断平衡移动的方向。由范特霍夫等压方程式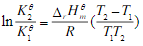 可知,
可知,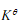 随温度的变化率只与有关
随温度的变化率只与有关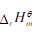 。当
。当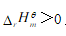 ,即吸热反应,T升高,
,即吸热反应,T升高,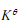 变大,反应将向正反应(即吸热反应)移动。
变大,反应将向正反应(即吸热反应)移动。
关注下方微信公众号,在线模考后查看

热门试题
- 已知100kPa,18℃时1molZn溶
- 已知下列前三个反应的平衡常数分别为K<
- 总浓度一定的缓冲溶液缓冲比愈接近1,该溶
- 在101.3kPa和80.1℃下,苯的气
- PH3分子中P原子
- 反应H2(g)+B
- 计算298K下,c(H3
- 已知298K时,PbI2
- 在0.06mol˙kg-1
- 将含有0.1mol˙dm-3
- 两个反应I和II,反应I的活化能为EaI
- 下列描述电子运动状态的各量子数中,正确的
- 写出下列配合物的名称: [Co(H
- 已知0.10mol/L的H2<
- 配制pH=8.25的缓冲溶液,问在200
- 凡是氧化数降低的物质都是还原剂。
- 试判断下列各种物质各属何种晶体类型,并
- 下列物质中,标准生成焓为零的是()。
- He+离子原子核外
- 按IUPAC法,具有CH3