试题详情
- 简答题 经研究,反应
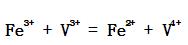 的反应机理为:
的反应机理为: 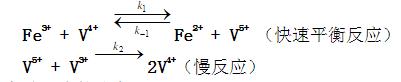 (1) 推导出正向总反应的速率方程; (2) 如果第一步的ΔHm = -20.92 kJ·mol-1,总的表观活化能 Ea = 50.2 kJ·mol-1。求第二步的活化能E2; (3) 对于第二步的逆向反应,25℃,如果k-2 = 0.01dm3·mol-1·s-1,根据过渡状态理论,与频率因子相应的数值按1013dm3·mol-1·s-1计算,活化熵
(1) 推导出正向总反应的速率方程; (2) 如果第一步的ΔHm = -20.92 kJ·mol-1,总的表观活化能 Ea = 50.2 kJ·mol-1。求第二步的活化能E2; (3) 对于第二步的逆向反应,25℃,如果k-2 = 0.01dm3·mol-1·s-1,根据过渡状态理论,与频率因子相应的数值按1013dm3·mol-1·s-1计算,活化熵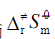 ·K-1计算其活化焓
·K-1计算其活化焓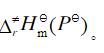
-
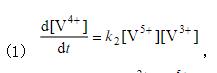
 。
。
关注下方微信公众号,在线模考后查看

热门试题
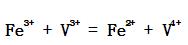 的反应机理为:
的反应机理为: 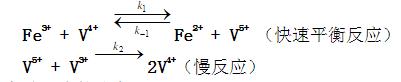 (1) 推导出正向总反应的速率方程; (2) 如果第一步的ΔHm = -20.92 kJ·mol-1,总的表观活化能 Ea = 50.2 kJ·mol-1。求第二步的活化能E2; (3) 对于第二步的逆向反应,25℃,如果k-2 = 0.01dm3·mol-1·s-1,根据过渡状态理论,与频率因子相应的数值按1013dm3·mol-1·s-1计算,活化熵
(1) 推导出正向总反应的速率方程; (2) 如果第一步的ΔHm = -20.92 kJ·mol-1,总的表观活化能 Ea = 50.2 kJ·mol-1。求第二步的活化能E2; (3) 对于第二步的逆向反应,25℃,如果k-2 = 0.01dm3·mol-1·s-1,根据过渡状态理论,与频率因子相应的数值按1013dm3·mol-1·s-1计算,活化熵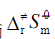 ·K-1计算其活化焓
·K-1计算其活化焓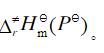
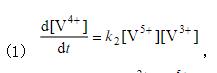
 。
。
关注下方微信公众号,在线模考后查看
