试题详情
- 简答题 对于两平行反应:
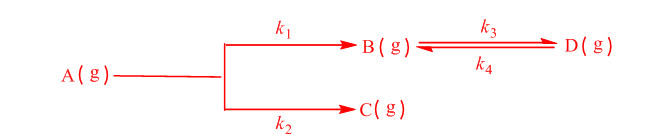 反应开始时只有A(g),且cA,0=0.02mol·dm-3,k1=3.0s-1,k2=2.5s-1,k3=4.0s-1,k4=5.0s-1。 (1)试写出分别用cA、cB、cC、cD表示的速率方程; (2)求反应物A的半衰期; (3)当反应物A完全反应(即cA=0)时,cB、cC、cD各位多少。
反应开始时只有A(g),且cA,0=0.02mol·dm-3,k1=3.0s-1,k2=2.5s-1,k3=4.0s-1,k4=5.0s-1。 (1)试写出分别用cA、cB、cC、cD表示的速率方程; (2)求反应物A的半衰期; (3)当反应物A完全反应(即cA=0)时,cB、cC、cD各位多少。
-

关注下方微信公众号,在线模考后查看

热门试题
- 下述说法中,哪一个是正确的?液体的温度越
- 证明等式
- 由丙酮(1)和甲醇(2)组成溶液,在10
- 在293.15K及101.325kPa
- 如下图所示,体系处于容器内,容器中间的半
- 在TK时,某一反应的速率常数为0.069
- 在如下图所示的CaF2
- 恒温时,封闭体系中亥姆霍兹自由能的降低量
- 举出两个例子,说明酸跟碳酸盐的反应原理在
- 放热反应2NO(g)+O2
- 已知298.15K时,反应时水的饱和蒸气
- 在电场中运动的离子其迁移率()
- 在某温度下,一密闭的刚性容器中的PCl<
- 某反应速率常数k =Q
- 如果液体的蒸汽压符合高压分布定律试由开尔
- 在简单低共熔物的相图中,三相线上的任何一
- 写出电池Pt|H2
- 已知反应2NaHCO3
- 对于U 、N、V确定的体系,其微观状态数
- ()