试题详情
- 简答题 在298K时,将Fe3+/Fe2+电极和Ag+/Ag电极构成原电池。已知φ0Fe3+/Fe2+=0.771V,φ0Ag+/Ag=0.799 V,[Fe3+]=1.00mol·L-1,[Fe2+]=0.01mol·L-1, [Ag+]=1.00mol·L-1, (1)计算原电池的电动势,写出原电池符号; (2)写出电池反应,并计算其平衡常数。
-
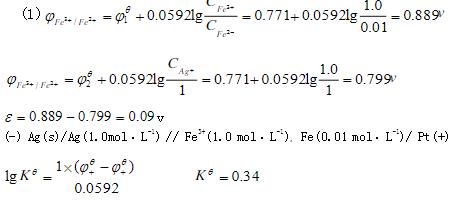
关注下方微信公众号,在线模考后查看

热门试题
- 在H2S饱和溶液中
- 24号元素电子层结构及元素名称为()
- 不经过计算推论在相同温度下,下列哪一个反
- 所谓SP3杂化,是
- 将10ml,0.30 mol.L
- 一个2p电子可以被描述为下列六组量子数
- 电极反应CuCl2
- 乙醇的(同分)异构体是:()
- 298K标准状态下,1molC(石墨)、
- 在烧杯中盛放20.00cm3
- 应用标准热力学数据计算298.15K时A
- 对于放热的熵减小的反应,必定是高温自发而
- 升高温度,使吸热反应的反应速率增大,放热
- 下列关于活化能的叙述中,不正确的是:()
- 等温等压下且不做非体积功条件下,反应自发
- 下列关于稀溶液的通性说法*不正确的是()
- 热的物体比冷的物体含有更多的热量。
- 对于某一化学反应,下列哪种情况下该反应的
- 在下列氧化剂中,哪些物质的氧化性随H<
- 同一化学反应,当条件变更时,活化能减少,