试题详情
- 简答题计算题:试述两瓶法测定水样中的溶解氧的测定方法。
-
水样中的溶解氧的测定方法:
①在采取水样前,先将取样瓶、取样桶洗净,并冲洗取样管。然后将二个取样瓶放在取样桶内,在取样管上接一个玻璃三通,并把三通上联接的二根厚壁胶管分别插入二个取样瓶底,调整水样流速为700mL∕min左右。并使水样溢流一定时间,使瓶内气体驱尽。当水样液位超过取样瓶口150mm后,将取样管轻轻地由瓶中抽出。
②立即在水面下往第一瓶水样中加入1mL氯化锰或硫酸锰溶液。
③往第二瓶水样中加入5mL磷酸溶液(1∶1)或硫酸溶液(1∶1)。
④用滴定管往两瓶中各加入3mL碱性碘化钾混合液,将瓶塞盖紧,然后由桶中将两瓶取出,摇匀后再放置在水面下。
⑤待沉淀物下沉后,打开瓶盖,在水面下向第一瓶水样内加入5mL磷酸溶液(1∶1)或硫酸溶液(1∶1),向第二瓶内加入1mL氯化锰或硫酸锰溶液,将瓶塞盖好,立即摇匀。
⑥将水样溶液冷却到15℃以下,各取出200~250mL,分别注入两个500mL锥形瓶中。
⑦分别用硫代硫酸钠标准溶液滴定至浅黄色,加入1mL1%淀粉指示剂,继续滴定至蓝色消失为止。
⑧水样溶解氧(O2)的含量按下式计算:
ρ(O2)=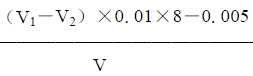 ×1000mg∕L
×1000mg∕L
式中:V1——第一瓶水样在滴定时所消耗的0.01mol∕L硫代硫酸钠标准溶液的体积,相当于水样中所含有溶解氧、氧化剂、还原剂和加入的碘化钾混合液所生成的碘量以及所有试剂中带入的含氧总量所生成的碘量,mL;
V1——第二瓶水样在滴定时所消耗的0.01mol∕L硫代硫酸钠标准溶液的体积,相当于水样中所含有氧化剂、还原剂和加入的碘化钾混合液所生成的碘量,mL;
0.01——硫代硫酸钠(Na2S2O3)标准溶液的浓度,mol∕L;
8——1∕4氧气的摩尔质量,g∕mol;
0.005——由试剂带入的溶解氧的校正系数(用容积约500mL的取样瓶取样,并取出200~250mL试样进行滴定时所采用的校正值);V——滴定溶液的体积,mL。 关注下方微信公众号,在线模考后查看

热门试题
- 过热器逆流布置时,由于传热平均温差大,传
- 在开口系统中,温度开始上升时,腐蚀速度加
- 溴、氨水及乙醇等,应放在棕色瓶内并置于冷
- 水泵内进空气将造成离心泵不上水。
- 联锁保护鼓、引风机同步停止法适用于()锅
- 再生剂的比耗是()。
- 在自然循环锅炉中的水每终过一次循环,只有
- 因为氯根离子测定应在中性或弱碱性条件下进
- 热水锅炉的出力就是指其蒸发量。
- 工业锅炉节能监测合格指标有热效率、排烟温
- 硫细菌会利用硫、硫代硫酸盐氧化所放出的热
- 水位表常见的故障有()等数种。
- ()是属于燃油锅炉。
- 持证作业人员以考试作弊或者以其他欺骗方式
- 锅炉房如设在多层或高层建筑的半地下室或第
- 气体燃料是锅炉燃料中最为理想的燃料,是最
- 反渗透膜用特定的高分子材料制成的,具有半
- 患有精神痛,癫痫病、()、心脏痛、精神不
- 蒸汽锅炉的给水管道上()。
- 煤中含量最多的可燃元素是()。