试题详情
- 简答题
背景材料:
阅读下列三段材料,根据要求完成任务。
材料一《普通高中化学课程标准(实验)》关于离子反应的内容标准:知道酸、碱、盐在溶液中能发生电离,通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。
材料二某版本高中实验教科书《化学1》“离子反应”的部分内容:
一、酸、碱、盐在水溶液中的电离
我们在初中曾观察过酸、碱、盐在水溶液中导电的实验现象。不仅如此,如果将氯化钠、硝酸钾、氢氧化钠等固体分别加热至熔化,它们也能导电。这种在水溶液或熔融状态下能够导电的化合物叫作电解质。
酸、碱、盐在水溶液中能够导电,是因为它们在溶液中发生了电离,产生了能够自由移动的离子。
例如,将氯化钠加入水中,在水分子作用下,钠离子(Na+)和氯离子(Cl-)脱离NaCl晶体表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子(如图2-9),NaCl发生了电离。这一过程可以用电离方程式表示如下(为方便起见,仍用离子符号表示水合离子):
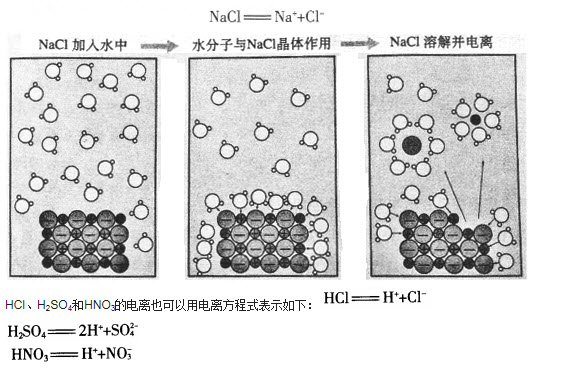 HCl、H2SO4和HNO3都能电离出H+,因此,我们可以从电离的角度对酸的本质有一个新的认识。电离时生成的阳离子全部是氢离子(H+)的化合物叫作酸。
【思考与交流】
请参考酸的定义,尝试从电离的角度概括出碱和盐的本质。
材料三教学对象为高中一年级学生,他们在初中学过电离的初步知识。
问题; (1)完成“酸、碱、盐在水溶液中的电离”的教学设计片段,内容包括教学目标、教学重难点、教学方法和教学过程。 (2)对本课教学内容进行板书设计。
HCl、H2SO4和HNO3都能电离出H+,因此,我们可以从电离的角度对酸的本质有一个新的认识。电离时生成的阳离子全部是氢离子(H+)的化合物叫作酸。
【思考与交流】
请参考酸的定义,尝试从电离的角度概括出碱和盐的本质。
材料三教学对象为高中一年级学生,他们在初中学过电离的初步知识。
问题; (1)完成“酸、碱、盐在水溶液中的电离”的教学设计片段,内容包括教学目标、教学重难点、教学方法和教学过程。 (2)对本课教学内容进行板书设计。
-
(1)一、教学目标
知识与技能:了解电解质的含义,并能够分辨电解质、非电解质;了解电解质导电的原因,会书写电离方程式;从电离角度认识酸、碱、盐。
过程与方法:通过类比,理解电解质和非电解质的区别;通过类比分析,从电离角度得出酸、碱、盐的概念。
情感态度与价值观:通过概念的学习,培养严谨的科学态度。
二、教学重难点
教学重点:电离及电解质的概念、电离方程式的书写。
教学难点:电解质、非电解质的判断。
三、教学方法
引导探索法、讲授法。
四、教学过程
 (2)板书设计
(2)板书设计
第二节离子
一、酸、碱、盐在水溶液中的电离
1.电解质:在水溶液或熔融状态下能够导电的化合物
常见:酸、碱、盐,活泼金属氧化物、水
2.非电解质:在水溶液和熔融状态下都不能导电的化合物
常见:大部分非金属氧化物(CO2、SO2)、大部分有机物(蔗糖、乙醇)NH3
3.电离:产生自由移动离子的过程
条件:溶于水、受热熔化
4.电离方程式:用化学式和离子符号表示电离过程的式子
5.从电离的角度认识酸、碱和盐
酸:电离时生成的阳离子全部是氢离子的化合物
碱:电离时生成的阴离子全部是氢氧根离子的化合物
盐:电离时生成金属阳离子(或铵根离子)和酸根阴离子的化合物 关注下方微信公众号,在线模考后查看

热门试题
- 某青年教师按照校内著名化学特级教师&l
- 背景材料: 阅读下面文字,回答
- 下列括号内所选试剂达不到检验效果的是()
- 分类方法在化学学科的发展中起着重要的作用
- 背景材料: 迅猛发展的化学已成
- “举一反三”“触类旁通”属于()。
- 小宇是一名高一的学生,他对文科感兴趣,非
- 物质分类是我们化学学习中必须掌握的一种
- 背景材料: 《普通高中化学课程
- 背景材料: 某教师关于“
- (1)化学课程目标确立的依据有哪些?(2
- 背景材料: 阅渎下列三段高中化
- 背景材料: 联系学生生活实际创
- 背景材料: 问题: (1)试确定本课
- 实验导入是化学课堂导入的基本类型。请以“
- 背景材料: 普通高中化学课程标
- 背景材料: 已知某混合金属粉末
- 下列化合物中不具有顺反异构的是()。
- 背景材料: 概念图是由美国康奈
- 背景材料: 以下是某教师在&l