试题详情
- 简答题 请对《全日制普通高级中学教科书(必修)化学第二册》第三章第三节“生活中两种常见的有机物”(第二课时)内容进行教学过程设计,教学设计必需的基本分析具体包括: (1)相关内容的地位和作用分析; (2)教学目标分析; (3)教学重、难点分析; (4)教学过程设计。
-
(1)在初中化学中,只简单地介绍乙酸的用途,没有从组成和结构角度认识其性质、存在和用途。乙酸是学生比较熟悉的生活用品,又是典型的烃的衍生物,并且学生在上节课的学习中已经知道官能团对有机物性质的重要影响,建立了“(组织)结构--性质--用途”的有机学习模式。因此本节课仍然按照“结构--性质--用途”的思路设计教学方法,让学生进一步理解官能团与性质的关系。
(2)教学目标
知识与能力:
①了解乙酸的分子式和结构式,理解羧基的结构特点;
②理解酯化反应的概念;掌握乙酸的酸性和酯化反应等化学性质;
③能够初步熟悉乙酸的酯化反应实验的有关操作。
过程与方法:
①通过展示乙酸分子的球棍模型及实物,进一步认识乙酸的分子结构及其物理性质;
②采用复习回忆法及实验验证法学习乙酸的酸性;
③通过实验探究、设疑学习乙酸的酯化反应,明确酯化反应的实质。
情感态度与价值观:
①培养观察能力、分析归纳思维能力;
②能够通过乙酸用途等的学习,认识化学与生产生活的密切联系,从而激发学习化学的兴趣,提高学习化学的积极性。
(3)教学重点:①乙酸的酸性;②乙酸的酯化反应。
教学难点:乙酸酯化反应的实质。
(4)教学过程
[引入]上节课我们学习了乙醇的结构和一些重要的性质,知道它是酒的主要成分,那你又是否知道:为什么酒的年份越长味道就越香?厨师烧鱼时加醋并加点酒,鱼的味道就变得无腥、鲜美?通过本节课的学习我们就能够知道其中的奥妙。
[板书]生活中两种常见的有机物--乙酸[讲述]俗话说:“百姓出门七件事:柴、米、油、盐、酱、醋、茶。”其中说到的醋的主要成分就是乙酸,所以乙酸又叫醋酸。下面我们就来学习乙酸的结构和性质。
[展示]无水乙酸样品,让学生观察并总结乙酸的物理性质(颜色、状态和气味)。
[板书]一、物理性质
1.无色有强烈刺激性气味的液体
2.易溶于水、乙醇等溶剂
3.沸点:117.9℃熔点:16.6℃
[讲述]当温度低于16.6℃时无水乙酸易凝结成像冰一样的晶体,所以无水乙酸又称为冰醋酸。
[过渡]刚才我们已经了解了乙酸的一些外观特征,那么乙酸分子的内部结构又是怎样的呢?我们来看看乙酸分子的结构模型。
[展示]乙酸分子的球棍模型,让学生总结乙酸的化学式、结构式和结构简式。
[板书]二、分子组成与结构
化学式:C2H4O2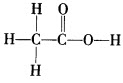
结构式:
结构简式:CH3COOH
官能团:羧基(-COOH)
[讲述]乙酸可以看作是由甲基和羧基组成的。
[过渡]结构决定性质,那么接下来我们通过几个小实验来研究一下乙酸有哪些化学性质。
[板书]三、化学性质
[师]根据初中已学知识,大家说说乙酸有什么性质?
[生]弱酸性。
[师]根据下列药品,设计实验证明乙酸具有酸性。
药品:镁条、NaOH溶液、Na2CO3粉末、乙酸溶液、酚酞
[学生自主设计实验]
[实验一]乙酸与镁的反应
实验步骤:向一支试管中加入少量乙酸,将一小段镁条放入试管,观察现象。
[教师]观察到什么现象就可以说明乙酸有酸性?
[学生]有气泡产生。
[投影]化学反应方程式: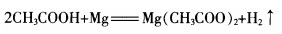
[实验二]乙酸与碳酸钠的反应
实验步骤:向一盛有少量碳酸钠粉末的试管里,加入约3mL乙酸溶液,观察现象。
[教师]观察到什么现象就可以说明乙酸有酸性?
[学生]试管里有无色、无味的气泡生成。
[教师]从这个实验还可以看出乙酸和碳酸的酸性谁比较强?
[学生]根据强酸制弱酸原理,乙酸酸性比碳酸的酸性强。
[板书]化学反应方程式: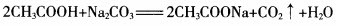
[教师]还有其他实验可以证明乙酸具有酸性吗?
[学生]可以利用乙酸和氢氧化钠的反应来证明。
[教师]乙酸和氢氧化钠反应有明显现象吗?
[学生]没有。
[教师]那如何知道它们发生反应呢?
[学生]先取氢氧化钠溶液于试管中,加入一滴酚酞,出现红色,再逐滴加入乙酸,如果红色褪去则说明乙酸具有酸性。
[教师]很好。
(学生实验)
[板书]化学方程式: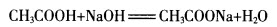
[归纳]通过前面几个小实验可以证明乙酸具有酸的通性:能与活泼金属、碱、盐等物质发生反应。乙酸的酸性比硫酸、盐酸等的酸性弱,但比碳酸的酸性强。
(观看“除去水垢”漫画,说出其中的道理。)
[投影]乙酸除去水垢的原理:
[板书]1.乙酸是一种有机弱酸,具有酸的通性。
酸性强弱:H2SO4>CH3COOH>H2CO3
[过渡]乙酸除了具有酸的通性外,还有什么其他化学性质呢?
(观看漫画“喝醋解酒”)
[教师]难道喝醋真的可以解酒吗?醋和酒能够反应吗?
[演示实验]乙酸与乙醇的反应
[实验步骤]在试管里先加入3mL无水乙醇,再一边摇动一边慢慢地加入2mL浓硫酸和2mL无水乙酸。然后用酒精灯小心均匀地加热试管3~5min,同时将导管通到装有饱和碳酸钠溶液的试管中,观察现象,注意产物的气味。
(强调加入试剂的顺序,注意产物气味是否与酒精相同)
[提问]饱和碳酸钠溶液中有何现象?
[学生]出现分层,有不溶于水,具有果香味的无色透明油状液体生成。
[教师]上层物质是挥发出来的乙酸或者乙醇吗?
[学生]不是,因为乙酸和乙醇都可以溶于水,不会出现分层。
[教师]那上层物质是什么呢?
[学生]是乙酸和乙醇反应新生成的物质。
[讲述]实验证明:乙酸与乙醇在有浓硫酸存在并加热的条件可以发生反应,实验中生成的有果香味的无色透明油状液体叫乙酸乙酯。像这种酸跟醇作用生成酯和水的反应叫酯化反应,且乙酸与乙醇的酯化反应是可逆的。
[板书]2.酯化反应:酸跟醇作用生成酯和水的反应叫酯化反应。
[教师提问]如果不加热反应能够发生么?加热的目的是什么?
[学生讨论后回答]不加热也可以反应,比如酒越存越香,就是因为生成了乙酸乙酯,加热目的是提高反应速率;使生成的乙酸乙酯挥发,有利于收集乙酸乙酯。
[教师提问]浓硫酸的作用是什么?
[学生]催化剂和脱水剂、吸水剂。
[教师提问]饱和碳酸钠溶液有何作用?是否为了吸收乙酸乙酯?
[学生回答]乙酸乙酯不溶于水中,饱和碳酸钠溶液是用于吸收挥发出来的乙酸和乙醇。
[教师提问]长导管有何作用?导管为何不能伸入饱和碳酸钠溶液中?
[学生]长导管具有导气和冷凝作用,导管口应置于液面上方,防止倒吸。
[教师提问]在酯化反应中乙酸和乙醇有几种可能的断键方式?
[投影]两种可能的断键情况,酸断羟基醇断氢,或者酸断氢醇断羟基。
[提问]如何确定实际发生的是哪种断键方式?
[学生思考][教师]利用同位素原子示踪法验证酯化反应的实质。
[动画演示]同位素原子示踪法
[板书]酯化反应的实质:酸脱羟基、醇脱氢(羟基上的)。
[过渡]性质决定用途,乙酸具有酸性,且能够发生酯化反应,决定了它具有以下广泛的用途。
[投影]四、乙酸的重要用途
乙酸是一种重要的有机化工原料。可用于生产醋酸纤维、合成纤维、喷漆溶剂、香料、染料、医药以及农药等。同时,乙酸是食醋的重要成分,也可用于杀菌消毒。
[随堂练习]
1.关于乙酸的下列说法中不正确的是()。
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有刺激性气味的液体
D.乙酸分子里有四个氢原子,所以不是一元酸
2.酯化反应属于()。
A.中和反应
B.不可逆反应
C.离子反应
D.取代反应
3.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有()。
A.1种
B.2种
C.3种
D.4种
[板书设计]
生活中两种常见的有机物--乙酸
一、物理性质
二、分子组成与结构
化学式:C2H4O2
结构式:
结构简式:CH3COOH
官能团:羧基(-COOH)
三、化学性质
1.乙酸是一种有机弱酸,具有酸的通性。
酸性强弱:H2SO4>CH3COOH>H2CO3
2.酯化反应:酸跟醇作用生成酯和水的反应叫酯化反应。
酯化反应的实质:酸脱羟基、醇脱氢(羟基上的)
四、乙酸的重要用途 关注下方微信公众号,在线模考后查看

热门试题
- 背景材料: 材料一高中化学《化学1》
- 背景材料: 阅渎下列三段高中化
- 小宇是一名高一的学生,他对文科感兴趣,非
- 请对《全日制普通高级中学教科书(必修)
- 一位化学教师在讲解“元素周期律”时,学生
- 背景材料: 某教师在一次
- 背景材料: 材料一高中化学《化学1》
- 背景材料: 某教师关于“
- 背景材料: 张老师在化学测验中
- 背景材料: 在做银镜反应的实验时,通
- 某青年教师按照校内著名化学特级教师&l
- 下列括号内所选试剂达不到检验效果的是()
- 背景材料: 在某100mL的混
- 背景材料: 《普通高中化学课程
- 背景材料: 把aL硫酸铵和硝酸
- 背景材料: 读下列三段材料,根据要求
- 背景材料: 下面是铝热反应的改
- 背景材料: 阅读下列三段高中化学教学
- 背景材料: 铁是人体必需的微量元素,
- 背景材料: 下列实验操作正确的